La maladie d'Alzheimer : Décoder le puzzle complexe
Par Dr. Miriam Sonntag
L'objectif de cet article est de faire la lumière sur les causes de la maladie d'Alzheimer et sur les moyens de les atténuer. Apprenez quels sont les choix alimentaires qui ont le plus d'impact. Obtenez des stratégies diététiques concrètes pour permettre à vos patients de prendre en charge le risque et la progression de leur maladie.
La maladie d'Alzheimer, principale cause de démence, est une maladie complexe. Est-elle causée par un seul gène ? Évolue-t-elle de manière soudaine ? Le risque peut-il être modifié par le mode de vie ? Découvrez les résultats de la recherche.
Maladie d'Alzheimer ou démence
Toutes les 3 secondes, une personne développe une démence (1). Cela représente près de 10 millions de cas par an. Dans le monde, plus de 55 millions de personnes sont atteintes de démence, ce qui en fait la 7e cause de décès chez les personnes âgées (2).
Bien qu'elles soient souvent utilisées de manière interchangeable, la maladie d'Alzheimer et la démence ne sont pas les mêmes.
La démence est un terme générique désignant des symptômes tels que la perte de mémoire, la confusion et la difficulté à accomplir les tâches quotidiennes. En revanche, la maladie d'Alzheimer est une affection neurodégénérative spécifique du cerveau. Elle est la principale cause de démence, représentant 60 à 80 % des cas. Pourtant, il ne s'agit que d'un type de maladie parmi d'autres, chacun caractérisé par des changements cérébraux uniques (2).
Image : Démence - Terme générique désignant les symptômes affectant les fonctions cognitives et les activités quotidiennes. La démence découle de diverses causes d'endommagement du cerveau qui coexistent souvent.
Changements cérébraux dans la maladie d'Alzheimer
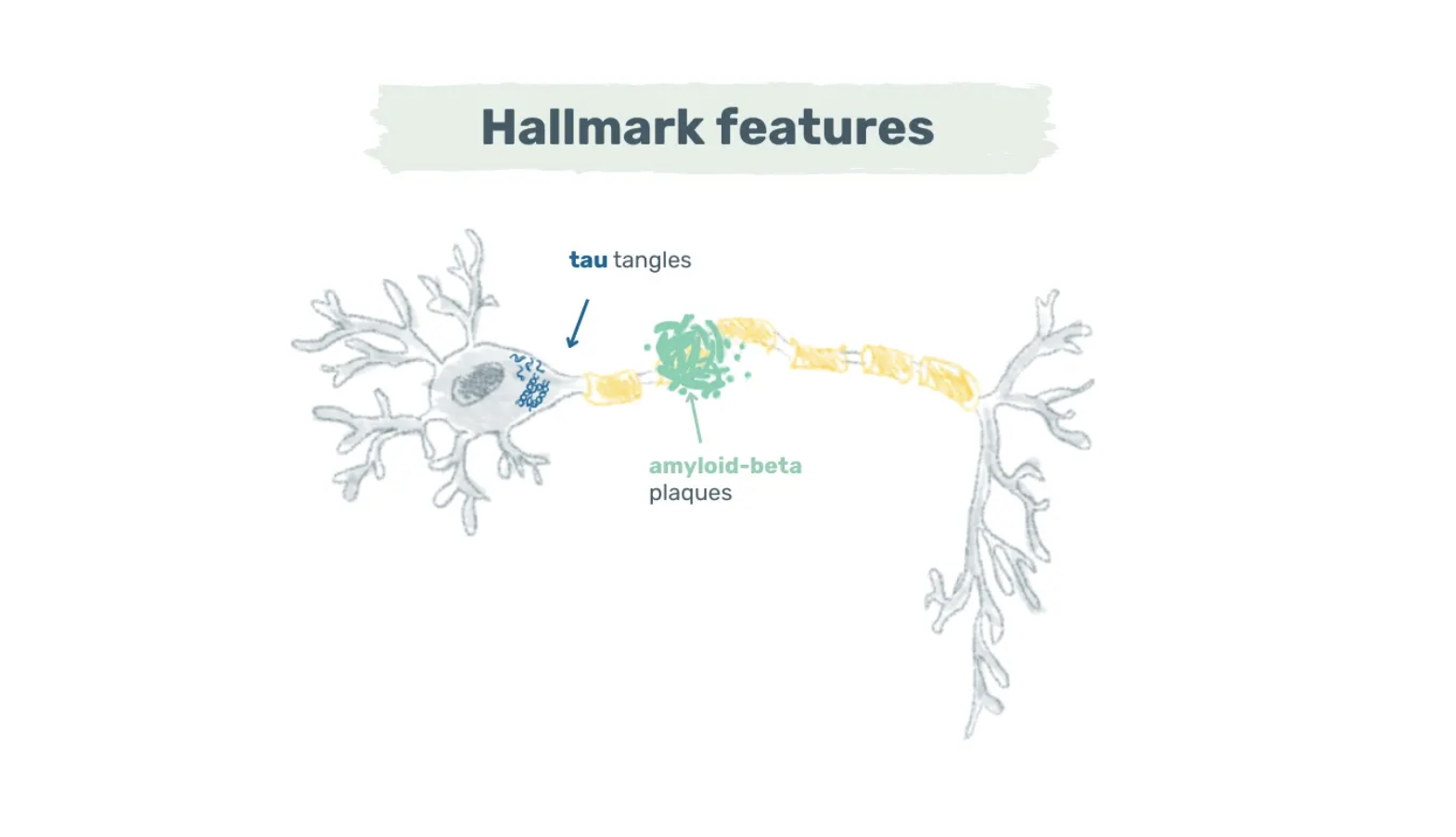
La maladie d'Alzheimer est une maladie neurodégénérative caractérisée par des plaques de bêta-amyloïde et des enchevêtrements de tau. Bien que la séquence exacte des événements soit encore à l'étude, les plaques amyloïdes-bêta se manifestent généralement en premier. Ces plaques sont principalement constituées de bêta-amyloïde, un peptide dérivé de la protéine précurseur de l'amyloïde exprimée dans les synapses (3).
Image : Caractéristiques de la maladie d'Alzheimer - Les plaques de bêta-amyloïde et les enchevêtrements de tau sont les deux principales caractéristiques de la maladie d'Alzheimer. Les plaques de bêta-amyloïde se regroupent autour des neurones, tandis que les enchevêtrements de tau se forment à l'intérieur des neurones.
Dans un cerveau sain, il existe un équilibre entre la production et l'élimination de la bêta-amyloïde. Dans la maladie d'Alzheimer, cependant, cet équilibre est rompu, ce qui entraîne des niveaux anormaux de bêta-amyloïde qui s'agrègent en plaques. Ces plaques se regroupent autour des neurones et perturbent la communication synaptique (4).
Bien qu'une certaine accumulation de plaques soit normale au cours du vieillissement, le moment où les plaques deviennent neurotoxiques reste complexe et n'est pas encore totalement compris (4). Lorsque les niveaux toxiques sont atteints, la protéine tau à l'intérieur des neurones devient hyperphosphorylée et s'agrège en enchevêtrements neurofibrillaires.
Ces enchevêtrements entravent le transport axonal, induisent un stress oxydatif et conduisent finalement à la mort neuronale. Les recherches indiquent une forte corrélation entre la quantité et la distribution des enchevêtrements de tau et le déclin cognitif (5).
Les plaques et les enchevêtrements sont des caractéristiques de la maladie d'Alzheimer. Ces deux caractéristiques peuvent être détectées par tomographie par émission de positrons et par des échantillons de plasma ou de liquide céphalorachidien (6). Cependant, d'autres changements se produisent également.
Des niveaux élevés de bêta-amyloïde et de tau activent la microglie, les macrophages résidents du système nerveux central. Au départ, ces cellules aident à éliminer les protéines toxiques, les agents pathogènes et les neurones endommagés. Cependant, lorsqu'elles sont confrontées à des quantités écrasantes de bêta-amyloïde et de tau, les microglies peuvent perdre leur fonctionnalité et une inflammation chronique peut s'installer.
L'inflammation chronique, à la fois facteur de risque et conséquence des plaques de bêta-amyloïde, endommage les neurones et les structures qui les soutiennent. La libération de cytokines et de chimiokines pro-inflammatoires alimente non seulement la neuroinflammation, mais entraîne également la mort cellulaire et l'atrophie cérébrale (5).
Les changements pathologiques commencent souvent dans le lobe temporal médian et l'hippocampe. Au fur et à mesure que les neurones meurent, des symptômes tels que la perte de mémoire, des troubles de la prise de décision ou des problèmes de langage peuvent apparaître (7). Toutefois, la séquence des régions cérébrales touchées, la manifestation des symptômes et la vitesse de progression peuvent varier d'une personne à l'autre.
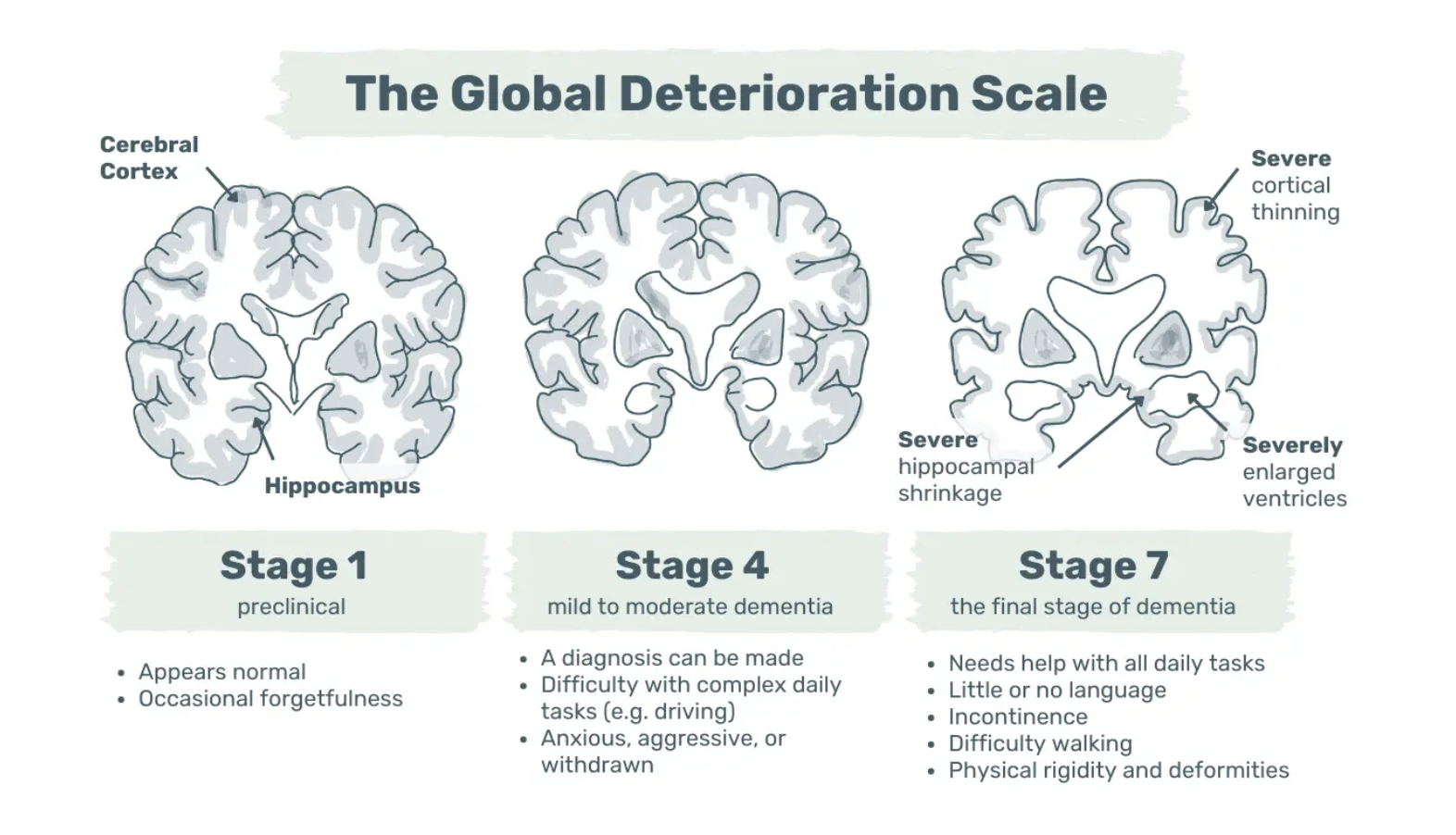
La démence d'Alzheimer progresse par étapes, depuis des changements cérébraux indétectables jusqu'à des troubles de la mémoire et un éventuel handicap physique. Au Royaume-Uni, le NHS et l'Alzheimer's Society classent les stades léger, modéré et sévère, tandis que l'échelle de détérioration globale décrit sept stades distincts (8,9).
Image : L'échelle de détérioration globale - Visualisation exemplaire des symptômes et des changements cérébraux aux stades 1, 4 et 7.
La maladie d'Alzheimer est-elle génétique ?
Il existe deux types principaux de maladie d'Alzheimer : la maladie d'Alzheimer précoce et la maladie d'Alzheimer tardive. La forme précoce, également connue sous le nom de maladie d'Alzheimer familiale, résulte d'une anomalie monogénique de l'un des trois gènes à risque connus : la protéine du précurseur de l'amyloïde, la préséniline-1 et la protéine préséniline-2.
Hériter de l'une de ces mutations autosomiques dominantes garantit pratiquement le développement de la maladie. Les symptômes de déclin cognitif apparaissent souvent avant l'âge de 65 ans, parfois dès 30 ans (10). Cependant, ces mutations sont rares et touchent moins de 10 % de la population (11).
La maladie d'Alzheimer à développement tardif touche principalement les personnes âgées de 65 ans ou plus, soit 90 % des personnes qui développeront la maladie. Contrairement à la maladie d'Alzheimer précoce, la maladie d'Alzheimer tardive est multifactorielle. Elle résulte d'une combinaison de facteurs liés à l'âge, à la génétique et au mode de vie.
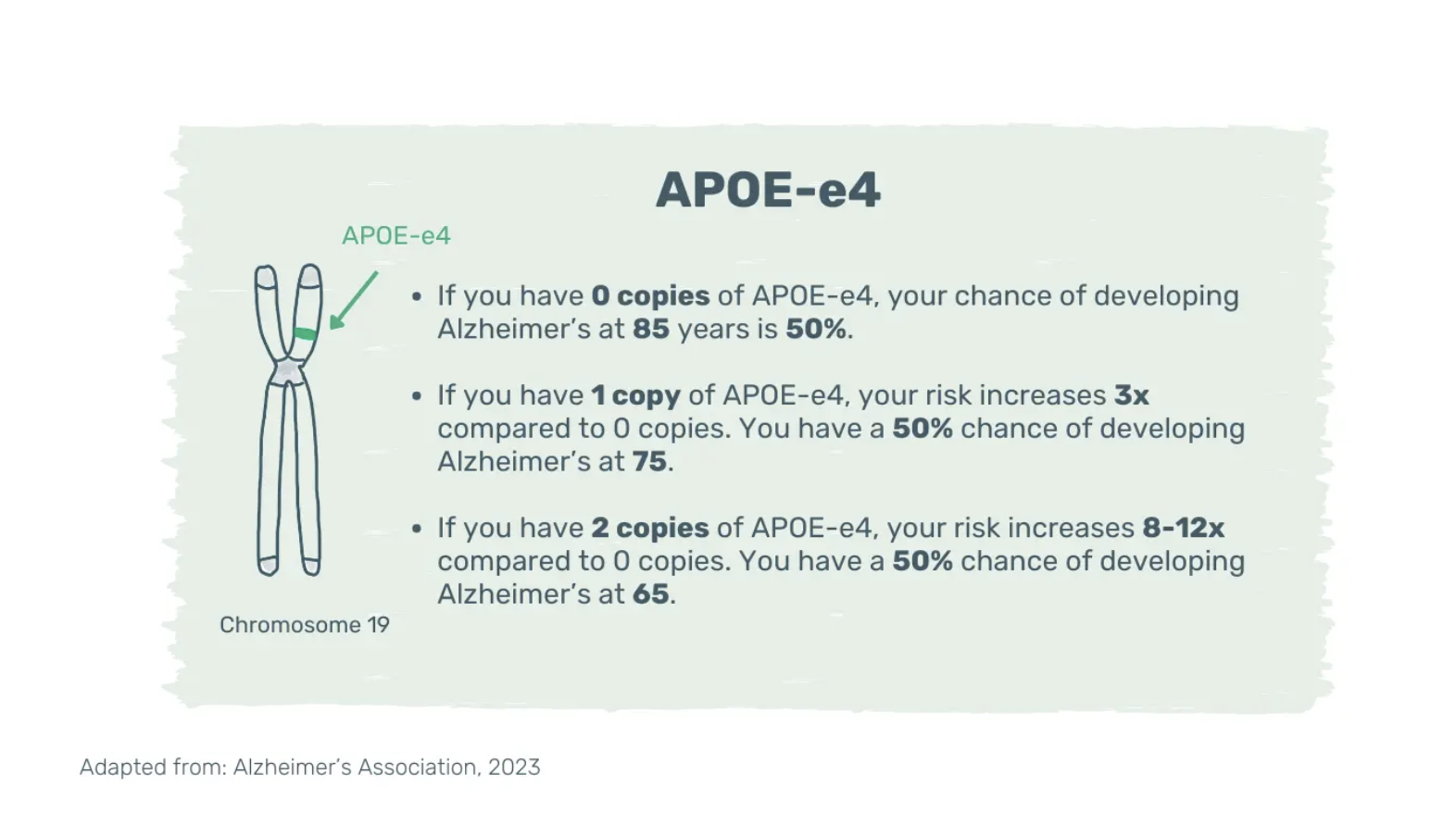
Le risque augmente avec l'âge, les antécédents familiaux de maladie d'Alzheimer et la présence de l'isoforme e4 du gène de l'apolipoprotéine E (APOE-e4). L'APOE-e4 est l'un des nombreux gènes associés à la maladie d'Alzheimer à début tardif et son effet est multiplicatif.
Le fait d'avoir plusieurs copies de l'APOE-e4 augmente le risque et pourrait réduire l'âge d'apparition de la maladie (12). Cependant, même deux copies d'APOE-e4 ne garantissent pas la maladie d'Alzheimer ; la maladie peut se développer avec ou sans APOE-e4 et vice versa. Des preuves de plus en plus nombreuses suggèrent que l'adoption d'un mode de vie sain peut contrecarrer la prédisposition génétique à la démence (13).
Image : Apolipoprotéine E-e4. Variante génétique liée à un risque accru d'apparition tardive de la maladie d'Alzheimer. APOE-e4 : isoforme E4 du gène de l'apolipoprotéine E.
La maladie d'Alzheimer est-elle une composante inévitable du vieillissement ?
L'âge est le facteur de risque connu le plus important et non modifiable de la démence. Le risque de développer la maladie d'Alzheimer double tous les cinq ans après 65 ans et atteint près de 40 % après 85 ans (14).
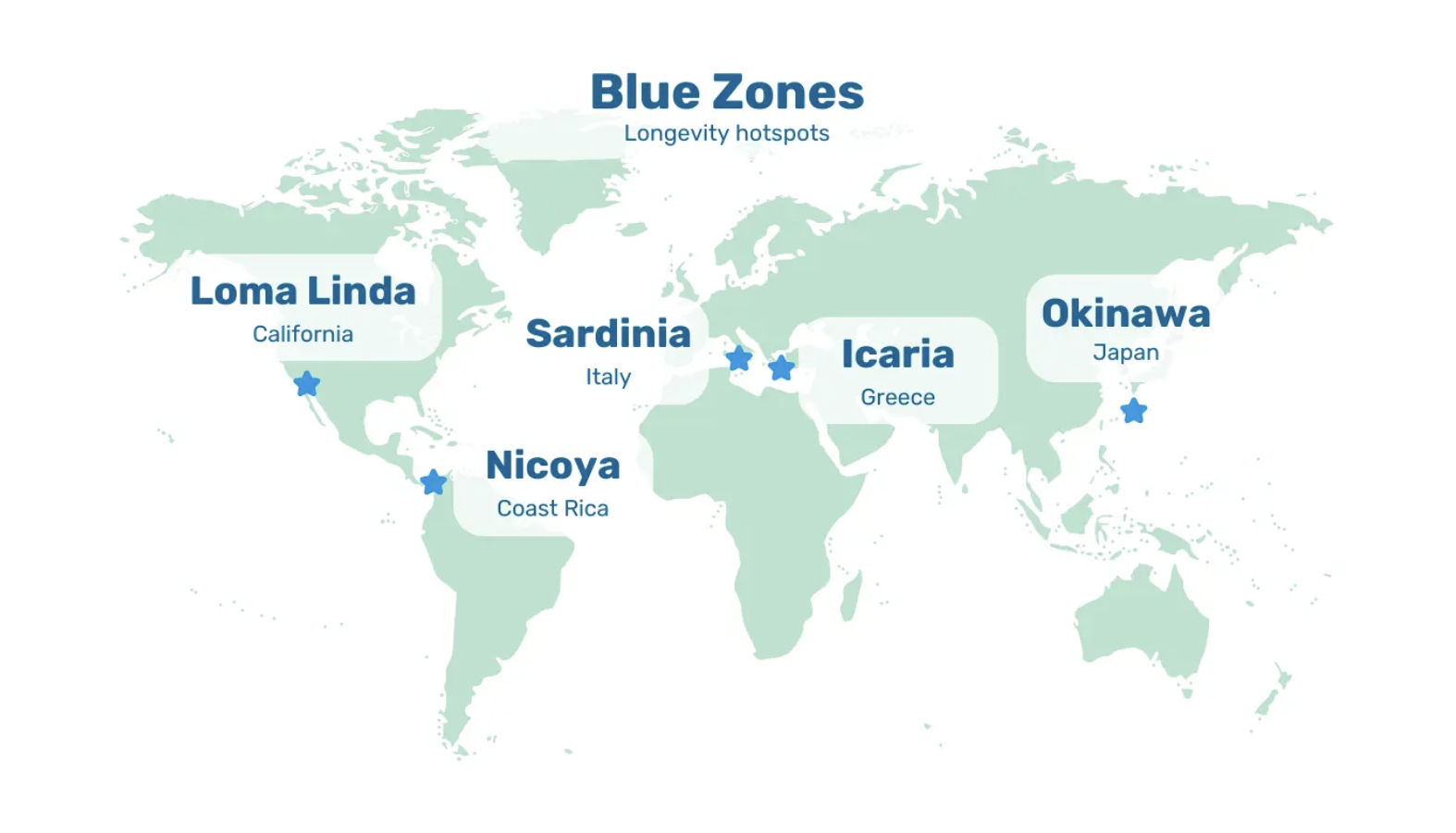
Cependant, même si la prévalence augmente avec l'âge, la démence n'est pas inévitable. Prenons l'exemple des habitants des zones bleues. Non seulement ils mènent une vie saine et active au-delà de 100 ans, mais ils sont moins susceptibles de développer un déclin cognitif ou une démence à un âge avancé.
Image : Zones bleues. Cinq zones géographiques dans le monde où les habitants vivent de manière mesurable plus longtemps, en meilleure santé et plus actifs physiquement au-delà de 100 ans.
Bien que les zones bleues soient réparties sur différents continents, elles partagent des caractéristiques de style de vie similaires. Par exemple, les habitants des zones bleues se déplacent naturellement tout au long de la journée, entretiennent des liens familiaux forts et étroits et adoptent un régime alimentaire essentiellement composé d'aliments complets et de plantes.
Ces observations concordent avec les conclusions du rapport Lancet de 2020 sur la prévention, l'intervention et les soins en matière de démence. Ce rapport estime qu'environ 40 % des cas de démence pourraient être évités ou retardés si l'on s'attaquait à l'ensemble des 12 facteurs de risque modifiables ci-dessous (15).
Image : 12 facteurs de risque modifiables de démence. Selon le rapport Lancet de 2020, ces 12 facteurs de risque représentent environ 40 % de tous les cas de démence.
Même de petits gestes en faveur d'un mode de vie plus sain peuvent réduire le risque de développer la maladie d'Alzheimer. En 2020, une étude a quantifié l'impact de cinq facteurs prédéfinis de mode de vie sain sur le risque de maladie d'Alzheimer. Les chercheurs ont suivi 2 675 personnes âgées de plus de 18 ans et leur ont attribué un score de 0 à 5 pour leur mode de vie (16).
Image : 5 Facteurs liés à un mode de vie sain. Les sujets ont reçu une note finale de 0 à 5, en fonction du nombre de facteurs de mode de vie sain qu'ils respectaient. Plus le score est élevé, plus le mode de vie est sain. MIND = Mediterranean-DASH Intervention for Neurodegenerative Delay ; DASH = Dietary Approaches to Stop Hypertension.
Voici ce qu'ils ont trouvé (16). Par rapport à ceux qui avaient ≤ 1 facteur de mode de vie sain :
les personnes ayant 2 ou 3 ans ont un risque réduit de 37 % de développer la maladie d'Alzheimer
les personnes atteintes de la maladie de 4 à 5 ans ont un risque réduit de 60 % de développer la maladie d'Alzheimer
Bien que la maladie d'Alzheimer à un stade avancé ne puisse pas être inversée, ces résultats ouvrent des perspectives considérables. Il est possible de prévenir ou de retarder l'apparition de la démence et de la maladie d'Alzheimer en adoptant très tôt un mode de vie sain et en le conservant tout au long de la vie (15).
Image : Citation tirée du rapport Lancet de 2020 sur la prévention, l'intervention et les soins en matière de démence.
Alimentation saine pour le cerveau
Le cerveau, qui représente 2 % du poids du corps, exige 25 % du glucose de l'organisme (17). Cette demande massive d'énergie fait de l'alimentation le principal facteur du mode de vie dans la lutte contre la maladie d'Alzheimer.
Des études d'observation ont montré de manière cohérente que manger plus de végétaux non transformés et moins de produits d'origine animale améliore la cognition. Voici quelques-unes de ces études.
En 2019, une étude de cohorte prospective sur plusieurs décennies a suivi 16 948 personnes âgées. Les sujets qui adhéraient le mieux aux modèles alimentaires à base de plantes, y compris les régimes méditerranéen et DASH, présentaient un risque de déclin cognitif inférieur de 18 à 33 % (18-20).
Le projet Rush Memory and Ageing a analysé les données de 923 patients vivant dans des communautés de retraite. Ceux qui suivaient strictement le régime MIND, un hybride du régime méditerranéen et du régime DASH, avaient un risque réduit de 53 % de développer la maladie d'Alzheimer. Plus remarquable encore, ceux qui suivaient modérément le régime MIND réduisaient également leur risque de 35 % (21).
Par rapport aux régimes méditerranéen et DASH, le régime MIND réduit davantage la consommation de poisson, de viande et de fromage à une fois par semaine (22). Il met davantage l'accent sur les légumes verts à feuilles sombres et les baies, qui ont tous deux été associés à un déclin cognitif plus lent (23, 24).
Les polyphénols et les caroténoïdes contenus dans les légumes à feuilles foncées et les baies ont des propriétés neuroprotectrices, anti-inflammatoires et antioxydantes. Une étude de cohorte portant sur 960 personnes âgées de 58 à 99 ans a conclu qu'une portion quotidienne de légumes verts à feuilles foncées pouvait ralentir le déclin cognitif lié au vieillissement. Les sujets qui en consommaient le plus, soit environ 1 à 3 portions, avaient un cerveau qui fonctionnait comme s'il avait 11 ans de moins (23).
Les baies sont riches en flavonols et en anthocyanes, deux polyphénols neuroprotecteurs. Les flavanols ont des propriétés antioxydantes et anti-inflammatoires. Les anthocyanes peuvent stimuler le flux sanguin vers le cerveau et la neuroplasticité dans l'hippocampe (25, 26). Des études ont montré que ≥ 1 portion hebdomadaire de baies peut retarder le vieillissement cognitif et réduire le risque de démence d'Alzheimer (24, 27, 28).
Outre les polyphénols neuroprotecteurs, les plantes regorgent de fibres. Les fibres végétales déclenchent la production d'acides gras à chaîne courte dans l'intestin. Les acides gras à chaîne courte renforcent la barrière hémato-encéphalique et protègent le cerveau de la dégénérescence (29). En outre, ils ont un effet antidépresseur, freinent la neuroinflammation et perturbent l'agrégation de l'amyloïde bêta toxique (30).
Des études ont montré que les patients atteints de la maladie d'Alzheimer présentent une diversité microbienne réduite et des niveaux plus faibles de microbes produisant des acides gras à chaîne courte (31, 32). Si la dysbiose est en corrélation avec la progression de la maladie, l'inverse est également vrai. Le rétablissement d'un microbiome sain peut prévenir ou ralentir la progression de la maladie d'Alzheimer (29).
Le Chicago Health and Ageing Project a étudié les effets des graisses alimentaires sur le risque de maladie d'Alzheimer. Ils ont conclu que des quantités élevées de graisses saturées et de graisses trans peuvent augmenter le risque, alors que les graisses dérivées des plantes peuvent protéger contre la maladie d'Alzheimer. Les sujets qui consommaient le plus de graisses saturées et de graisses trans avaient un risque 2,2 et 2,4 fois plus élevé que ceux qui en consommaient le moins (33). Une étude de 2012, qui a suivi 6 000 femmes pendant 4 ans, a montré que les femmes qui consommaient le plus d'acides gras insaturés avaient des fonctions cérébrales comparables à celles de leurs 6 ans de moins (34). Les noix, les graines, les avocats et les olives sont de bonnes sources de graisses saines.
Message à retenir
Les aliments végétaux complets regorgent de polyphénols neuroprotecteurs, de fibres et d'acides gras insaturés. Bien que la maladie d'Alzheimer soit incurable une fois qu'elle s'est déclarée, le mode de vie est important. Chaque pas vers plus de végétaux non transformés et moins de produits alimentaires ultra-transformés ainsi que moins de produits d'origine animale peut contribuer à prévenir ou à ralentir la progression des symptômes.
Conseils pour encourager vos patients à manger sainement
Commencez par les changements les plus faciles à mettre en œuvre par votre patient, même le jour le plus difficile. Pour obtenir des résultats durables, il est préférable de ne pas commencer tout de suite par l'aliment préféré, mais de supprimer d'abord un autre aliment. N'oubliez pas de toujours proposer des substituts sains et savoureux.
Adopter un régime alimentaire complet, à base de plantes ou, du moins, à prédominance végétale.
Choisissez des graisses saines : Remplacez les graisses saturées par des graisses saines et non saturées.
Augmentez votre consommation de fibres : Remplacez les céréales raffinées par des céréales complètes et ajoutez des légumineuses.
Choisissez des protéines saines : remplacez la viande et la volaille par des légumineuses et des produits à base de soja.
Consommez une dose quotidienne de légumes verts feuillus : Salade, chou frisé, épinards ou roquette.
Faites le plein de flavanols : consommez chaque jour toutes sortes de baies.
Informations complémentaires :
-
Dr. Miriam Sonntag is the Medical Content Executive of the online learning platform, PAN Academy. Having worked in basic research, she knows how to decipher complex information. Working now at PAN, she scans and pours over scientific papers and books. She breaks down the latest nutritional research into actionable advice for everyday life. She is committed to sharing the bigger picture of why it is good to put more plants on your plate.
-
For more information on this topic, download the Alzheimer’s Patient Factsheet.
For more information on this topic, download the Alzheimer’s Physician Factsheet.
-
Alzheimer’s Disease International, 2021. Dementia statistics. Available from: https://www.alzint.org/about/dementia-facts-figures/dementia-statistics. Accessed 8 Feb 2024
WHO, 2023. Dementia. Available from: https://www.who.int/news-room/fact-sheets/detail/dementiaAccessed 8 Nov 2023
Walker LC, 2020. Aβ plaques. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7745791/
Kok FK et al, 2022. Potential mechanisms underlying resistance to dementia in non-demented individuals with Alzheimer’s disease neuropathology. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9198800/
Ferrari C & Sorbi S, 2021. The complexity of Alzheimer’s disease: an evolving puzzle. Available from: https://journals.physiology.org/doi/full/10.1152/physrev.00015.2020
Jack, 2022. Advances in Alzheimer’s disease research over the past two decades. Available from: https://www.thelancet.com/journals/laneur/article/PIIS1474-4422(22)00298-8/fulltext
Calabrò M et al, 2021. The biological pathways of Alzheimer disease: a review. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7815481/
Reisberg B & Franssen E, Clinical stages of Alzheimer’s. Available from: https://www.alzinfo.org/understand-alzheimers/clinical-stages-of-alzheimers. Accessed 21 Dec 2023
Alzheimer’s Society, 2021. The progression, signs and stages of dementia. Available from: https://www.alzheimers.org.uk/about-dementia/symptoms-and-diagnosis/how-dementia-progresses/progression-stages-dementia. Accessed 29 Jan 2024
Alzheimer’s Association, 2023. 2023 Alzheimer’s disease facts and figures. Available from: https://onlinelibrary.wiley.com/doi/abs/10.1002/alz.13016
Robinson M et al, 2018. Recent progress in Alzheimer’s disease research, part 2: genetics and epidemiology. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/pmc6705191/
Liu C-C et al, 2013. Apolipoprotein E and Alzheimer disease: risk, mechanisms and therapy. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3726719/
Kuzma E et al, 2019. Genetic risk, lifestyle and dementia. Available from: https://onlinelibrary.wiley.com/doi/abs/10.1016/j.jalz.2019.06.4649
Kumar A et al, 2023. Alzheimer disease. Available from: http://www.ncbi.nlm.nih.gov/books/NBK499922/
Livingston G et al, 2020. Dementia prevention, intervention, and care: 2020 report of the Lancet commission. Available from: https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(20)30367-6/fulltext
Dhana K et al, 2020. Healthy lifestyle and the risk of Alzheimer dementia. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7455318/
Ardanaz CG et al, 2022. Brain metabolic alterations in Alzheimer’s disease. Available from: https://www.mdpi.com/1422-0067/23/7/3785
Wu J et al, 2019. Dietary pattern in midlife and cognitive impairment in late life: a prospective study in Chinese adults. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6766457/
Widmer RJ et al, 2015. The Mediterranean diet, its components, and cardiovascular disease. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4339461/
NIH, 2021. DASH Eating Plan. Available from: https://www.nhlbi.nih.gov/education/dash-eating-plan. Accessed 16 Feb 2024
Morris MC et al, 2015. MIND diet associated with reduced incidence of Alzheimer’s disease. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/pmc4532650/
Hosking DE et al, 2019. MIND not Mediterranean diet related to 12-year incidence of cognitive impairment in an Australian longitudinal cohort study. Available from: https://pubmed.ncbi.nlm.nih.gov/30826160/
Morris MC et al, 2018. Nutrients and bioactives in green leafy vegetables and cognitive decline. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5772164/
Devore EE et al, 2012. Dietary intakes of berries and flavonoids in relation to cognitive decline. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/pmc3582325/
Dodd GF et al, 2019. Acute effects of flavonoid-rich blueberry on cognitive and vascular function in healthy older adults. Available from: https://content.iospress.com/articles/nutrition-and-healthy-aging/nha180056
Shukitt-Hale B et al, 2015. The beneficial effects of berries on cognition, motor behaviour and neuronal function in ageing. Available from: https://doi.org/10.1017/S0007114515003451
Agarwal P et al, 2019. Association of strawberries and anthocyanidin intake with Alzheimer’s dementia risk. Available from: https://www.mdpi.com/2072-6643/11/12/3060
Holland TM et al, 2020. Dietary flavonols and risk of Alzheimer dementia. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/pmc7282875/
Silva YP et al, 2020. The role of short-chain fatty acids from gut microbiota in gut-brain communication. Available from: https://www.frontiersin.org/articles/10.3389/fendo.2020.00025
Ho L et al, 2018. Protective roles of intestinal microbiota derived short chain fatty acids in Alzheimer’s disease-type beta-amyloid neuropathological mechanisms. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5958896/
Vogt NM et al, 2017. Gut microbiome alterations in Alzheimer’s disease. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/pmc5648830/
Verhaar BJH et al, 2021. Gut microbiota composition is related to AD pathology. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/pmc8843078/
Morris MC et al, 2003. Dietary fats and the risk of incident Alzheimer disease. Available from: https://doi.org/10.1001/archneur.60.2.194
Okereke et al., 2012. Dietary fat types and 4-year cognitive change in community-dwelling older women. Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3405188/