Arthrite rhumatoïde et régime alimentaire : Guide du médecin
Par Carlijn Wagenaar, MD et Wendy Walrabenstein, RD & Présidente de PAN International Suisse
Vous est-il déjà arrivé d'être assis en face d'un patient atteint de polyarthrite rhumatoïde qui vous demandait des conseils en matière de régime alimentaire ou de mode de vie ? Quelles recommandations, le cas échéant, avez-vous données à votre patient ? Avec cet article de synthèse, nous espérons vous informer sur les données actuelles concernant le lien entre le mode de vie, et en particulier l'alimentation, et la polyarthrite rhumatoïde (PR). Nous espérons que vous serez en mesure d'utiliser ces connaissances pour conseiller vos patients la prochaine fois afin de leur permettre de faire des choix de vie sains.
Qu'est-ce que la polyarthrite rhumatoïde ?
L'arthrite est un terme général utilisé pour désigner les troubles qui affectent les articulations. S'il existe de nombreux types d'arthrite, l'un des plus courants est la polyarthrite rhumatoïde (PR), une maladie auto-immune systémique chronique qui provoque des douleurs et un gonflement des articulations et peut, à terme, entraîner des lésions articulaires et un handicap (1). La PR touche environ 0,24 % de la population mondiale, mais on estime que sa prévalence aux États-Unis et dans les pays d'Europe du Nord est encore plus élevée (entre 0,5 % et 1 %) (1-3).
Les progrès considérables réalisés dans le traitement de la PR, notamment l'introduction des antirhumatismaux modificateurs de la maladie (ARMM), ont permis de réduire les mauvais résultats à long terme (4,5). Cependant, les complications à long terme de la PR comprennent toujours l'incapacité physique et professionnelle, la réduction de la qualité de vie, les opérations de remplacement des articulations, le développement d'autres maladies chroniques (y compris les maladies cardiovasculaires) et la mortalité prématurée (6). L'impact financier de la PR sur la société et le système de santé reste donc important. La majeure partie de cet impact est due aux coûts des médicaments ainsi qu'aux coûts indirects liés à l'absentéisme et à l'incapacité de travail (7).
Quelles sont les causes de la polyarthrite rhumatoïde ?
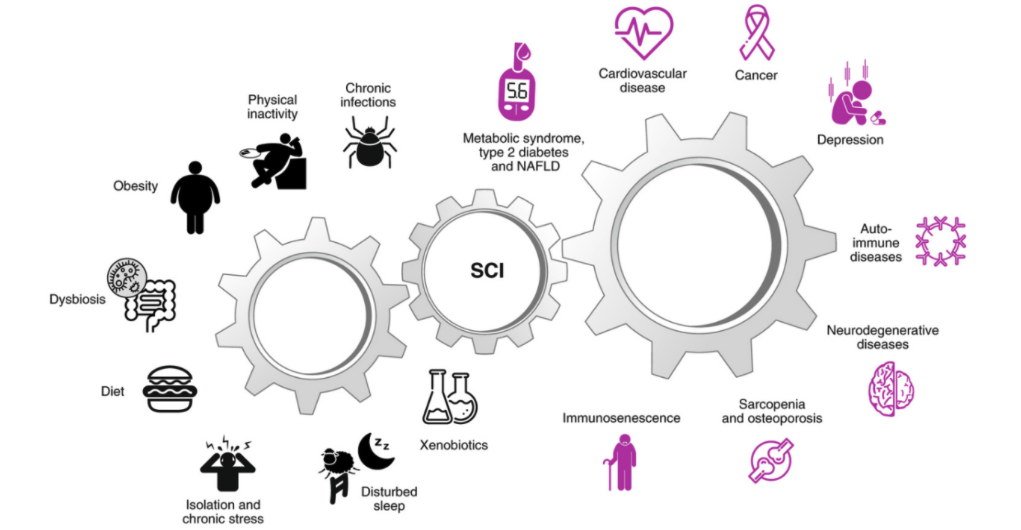
Environ 16 % des cas de PR sont dus, en partie, à des facteurs génétiques - bien que ce chiffre puisse être encore plus bas car certains gènes ne s'expriment que dans des environnements défavorables (8,9). En outre, une caractéristique clé de nombreuses maladies chroniques est la présence d'une inflammation de bas grade. L'inflammation de bas grade est généralement déclenchée par des facteurs (liés au mode de vie) tels que l'inactivité physique, l'obésité, le déséquilibre du microbiome, une mauvaise alimentation, le stress, un sommeil perturbé et l'exposition, par exemple, à la pollution atmosphérique ou au tabagisme (10). À son tour, l'inflammation de bas grade peut provoquer ou faciliter une rupture de la tolérance immunitaire, et donc jouer un rôle dans le développement de diverses maladies auto-immunes (10). En outre, l'inflammation de bas grade augmente avec l'âge et la combinaison du vieillissement et de l'inflammation (également connue sous le nom d'"inflammation") semble être associée à de nombreuses maladies chroniques, dont la PR (10).
Image : Causes et conséquences de l'inflammation chronique systémique de bas grade (10).
Quels sont les facteurs de mode de vie liés à la polyarthrite rhumatoïde ?
En outre, le risque de développer une PR est lié à divers facteurs liés au mode de vie, notamment :
Un régime alimentaire malsain (11)
Obésité (12,13)
Fumer (14, 13)
Mode de vie sédentaire (15)
Stress (16-18)
Dans cet article, nous allons nous concentrer sur la façon dont les choix alimentaires peuvent influencer la PR. Avant d'aborder les différents aspects de la nutrition, examinons brièvement comment chacun des facteurs liés au mode de vie mentionnés ci-dessus contribue au risque de PR.
L'alimentation : Une étude a montré que l'adhésion à long terme à un modèle alimentaire de meilleure qualité, en utilisant le score AHEI-2010, était associée à une réduction du risque de PR. Plus précisément, une plus faible consommation de viande rouge s'est avérée être l'un des éléments les plus associés à la réduction du risque de PR (11).
Obesity and smoking: Smoking and obesity also increase RA risk (12,13,14). One study found smoking increased the risk of developing RA by 10 times while overweight individuals (BMI≥25 kg/m²) had a 6-fold increased risk of developing RA compared to individuals at a normal weight (BMI<25 kg/m²) (13).
Sedentary lifestyle: Furthermore, physical activity has been found to be a protective factor for RA. One study grouped women based on physical activity levels and found those in the highest category (40 – 60 minutes per day walking/biking and 2 – 3 hours per week of exercise) had a 35% lower risk of RA compared to the lowest category (<20 minute per day of walking/bicycling and <1 hour per week of exercise) (15).
Le stress : L'apparition de la PR a également été liée au stress (16,18,19). Plus précisément, on a constaté que les personnes souffrant de stress post-traumatique ont un risque accru de 76 à 100 % de développer des troubles auto-immuns, y compris la PR (18,19).
Outre les choix alimentaires (sur lesquels nous reviendrons plus tard), les recommandations en matière de mode de vie pour tous les patients atteints de PR sont les suivantes :
Maintien d'un poids corporel sain
Faire suffisamment d'exercice (150 à 300 minutes d'activité physique aérobie modérée tout au long de la semaine et des activités de renforcement musculaire deux jours ou plus par semaine).
Limiter le temps de sédentarité
Arrêter de fumer
Réduire le stress (37, 72)
Les liens entre le microbiome et l'auto-immunité
Le microbiome est constitué de communautés de micro-organismes vivant sur et dans notre corps et remplit diverses fonctions, notamment la communication avec le système immunitaire pour soutenir son développement et réguler les réponses inflammatoires (20,21).
De nombreuses études ont établi un lien entre le microbiome et l'auto-immunité. Le consensus scientifique est clair : le microbiome intestinal joue un rôle dans le déclenchement et la conduite de l'auto-immunité systémique, bien qu'il y ait encore des discussions sur les moyens spécifiques par lesquels cela se produit (22). La composition et le ratio des espèces bactériennes au sein de cette communauté peuvent varier considérablement en fonction de nombreux facteurs, en particulier l'état de santé, une plus grande diversité de micro-organismes étant associée à une meilleure santé (23,24).
En outre, la dysbiose du microbiome intestinal (définie comme un déséquilibre dans la quantité et la fonction de la communauté microbienne intestinale) est associée à des maladies inflammatoires chroniques, y compris des maladies auto-immunes (24,25).
En outre, le microbiome intestinal des patients atteints de PR contient proportionnellement plus de certains types de bactéries comme Prevotella copri (en particulier chez les patients récemment diagnostiqués) et Lactobacillus salivarius (26). Il a été suggéré que Prevotella copri pourrait traverser la paroi intestinale et jouer un rôle dans le développement de la PR (27).
Des preuves de plus en plus nombreuses suggèrent que la dysbiose du microbiome peut également entraîner une perméabilité intestinale accrue ("leaky gut") et, en fin de compte, alimenter les réponses immunitaires de l'hôte et les troubles inflammatoires chroniques (20,28). En ce qui concerne spécifiquement la PR, un lien a été établi entre le microbiome buccal et les maladies gingivales, des bactéries spécifiques pouvant stimuler la production de composés inflammatoires susceptibles de déclencher des anticorps liés à la PR (29).
Régime alimentaire et polyarthrite rhumatoïde
Comme indiqué précédemment, les options thérapeutiques pour les patients atteints de PR se sont considérablement améliorées, mais moins de la moitié des patients parviennent à une rémission à long terme de la maladie et nombre d'entre eux subissent les effets secondaires des médicaments (30,31). Les interventions sur le mode de vie présentent toutefois un grand potentiel pour la prévention et le traitement de la PR, bien que l'impact de ces interventions soit souvent inconnu et qu'elles soient donc sous-utilisées.
Recommandations générales
Pour les patients atteints de PR et d'autres maladies rhumatismales inflammatoires, les recommandations générales pour une alimentation saine (telles que celles de l'OMS ou les recommandations nationales) constituent un bon point de départ (32, 72). Ces recommandations visent à réduire les facteurs de risque liés aux maladies cardiovasculaires, pour lesquelles les patients atteints de PR présentent un risque jusqu'à deux fois plus élevé que la population générale (33).
Les recommandations suivantes s'adressent à tous, y compris aux patients atteints de PR, pour une alimentation saine (32) :
Mangez une variété de fruits, de légumes, de légumineuses (lentilles, haricots, etc.), de noix et de céréales complètes (farine de blé complet, pâtes complètes, riz brun, etc.)
Essayez de consommer au moins 400 g de fruits et légumes (environ 5 portions) par jour.
Limitez les sucres ajoutés à moins de 12 cuillères à café de sucre par jour (mais moins de 6 cuillères à café est encore mieux) (par exemple, sucreries, sodas, jus de fruits, sirops).
Essayez de consommer moins de 5 g de sel par jour. On a constaté qu'une consommation excessive de sel était associée à un risque plus élevé de développer une polyarthrite rhumatoïde (34).
Visez un apport en graisses inférieur à 66 grammes par jour. Limitez la consommation de graisses saturées à moins de 22 grammes par jour. Les graisses saturées se trouvent principalement dans les produits d'origine animale tels que la viande, les produits laitiers et les œufs.
Les acides gras saturés et les acides gras oméga-6 sont associés à une augmentation de l'inflammation. Utilisez plutôt des huiles comme les graines de lin, riches en acides gras oméga-3, ou des huiles comme l'huile d'olive, riches en acides gras oméga-9 (35,36).
Les interactions entre les médicaments et l'alcool sont importantes à prendre en compte pour les patients atteints de PR. La consommation d'alcool est déconseillée à ceux qui prennent des AINS (anti-inflammatoires non stéroïdiens) ou d'autres médicaments métabolisés dans le foie ou associés à un risque accru de valeurs hépatiques anormales.
L'utilisation de suppléments nutritifs n'est pas nécessaire, sauf pour les personnes qui appartiennent à un groupe spécifique pour lequel une supplémentation est recommandée (pour plus d'informations, voir la section sur les suppléments ci-dessous).
Le rôle important des fibres alimentaires
Les fibres sont un élément clé d'un régime alimentaire sain. Un apport élevé en fibres semble améliorer la santé des personnes souffrant de maladies rhumatismales, car il est associé aux éléments suivants :
Réduction significative du risque de maladie cardiovasculaire
Diminution de la tension artérielle et du cholestérol sérique
Amélioration de la glycémie et de la sensibilité à l'insuline
Facilite la perte de poids
Semble améliorer la fonction immunitaire (38)
Il a également été démontré qu'une consommation accrue de fibres augmentait les cellules immunitaires anti-inflammatoires et diminuait les marqueurs d'érosion osseuse chez les patients atteints de PR (39).
L'apport quotidien en fibres joue également un rôle essentiel dans les modifications du microbiome associées à l'alimentation (25,40). Dans l'intestin, les glucides non digestibles sont fermentés par le microbiome pour former des acides gras à chaîne courte (AGCC), qui ont des propriétés anti-inflammatoires. En outre, certains types de fibres alimentaires peuvent stimuler de manière sélective la croissance de bactéries bénéfiques dans le côlon et donc favoriser la santé (40-43).
Les régimes riches en fibres (végétariens, méditerranéens, végétaliens), pauvres en viande rouge et riches en acides gras insaturés, sont associés à une composition plus bénéfique du microbiome, à une plus grande diversité microbienne, à un plus grand nombre de bactéries bénéfiques pour la santé et à des niveaux plus élevés d'acides gras saturés (42, 44-46). En revanche, les régimes occidentaux typiques, caractérisés par une forte consommation de graisses et de protéines animales et une faible consommation de fibres, montrent une diminution globale des bactéries totales et de certaines espèces bactériennes bénéfiques, tout en augmentant certaines bactéries pathogènes (42).
Les interventions alimentaires à base de plantes, telles que les régimes végétariens et végétaliens, se sont avérées systématiquement plus efficaces pour améliorer les résultats cliniques et microbiomiques que d'autres interventions alimentaires, y compris les régimes méditerranéens, chez les patients atteints de maladies inflammatoires chroniques, y compris la PR (47).
En particulier pour les personnes qui souffrent de douleurs abdominales lorsqu'elles mangent des aliments riches en fibres (comme les haricots), il peut être recommandé d'augmenter lentement l'apport en fibres, de manger une diversité d'aliments végétaux et d'incorporer des aliments fermentés dans le régime alimentaire (par exemple, kimchi, kombucha, choucroute, yaourt (de soja)). On a constaté que les aliments fermentés augmentent la diversité du microbiome et réduisent l'inflammation tout en ménageant l'intestin (48).
Régimes alimentaires complets à base de plantes et régime méditerranéen dans la polyarthrite rhumatoïde
Plusieurs études ont montré les avantages potentiels des régimes à base de plantes ou méditerranéens chez les patients atteints de PR. Un régime végétarien s'est avéré efficace au bout d'un an dans le cadre d'un essai norvégien contrôlé, en simple aveugle et randomisé, mené auprès de 53 patients atteints de PR (49). Dans cette étude, le groupe d'intervention a subi un jeûne de 7 à 10 jours dans une clinique, après quoi il a suivi un régime à base de plantes et sans gluten pendant 3,5 mois. Après cette période, les patients ont été autorisés à réintroduire le gluten et les produits laitiers pendant les 9 mois restants. L'inflammation, la douleur, la raideur matinale, le bien-être général, la force de préhension et le nombre d'articulations sensibles et douloureuses ont été mesurés régulièrement. Tous ces éléments se sont améliorés de manière significative à tous les moments par rapport à la ligne de base et au groupe de contrôle, qui suivait un régime standard (omnivore) (49).
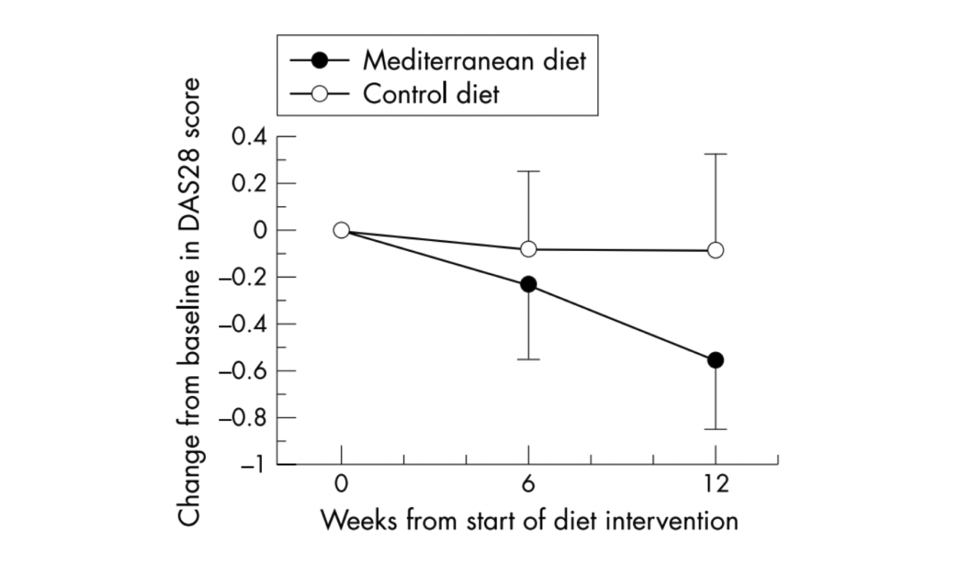
En outre, dans le cadre d'un essai contrôlé randomisé suédois portant sur 51 patients atteints de PR, l'effet d'un régime méditerranéen a été étudié sur l'activité de la maladie (à l'aide du score DAS28 - un score composite utilisé pour mesurer l'activité de la maladie dans le cas de la PR). La figure 1 montre que l'intervention a permis de réduire de manière significative l'activité de la maladie en l'espace de 12 semaines (50).
Image : Activité de la maladie (score DAS28) au départ et aux semaines 6 et 12. Les résultats sont présentés en termes relatifs, la valeur de base étant fixée à zéro, sous forme de valeurs moyennes avec des intervalles de confiance à 95 %. (50)
Une étude suédoise croisée plus récente a comparé un régime similaire riche en acides gras oméga-3 (provenant de poissons gras et de noix), en fibres, en antioxydants et en probiotiques à un régime suédois typique composé de plus grandes quantités de protéines animales, de graisses et de céréales raffinées. Après 10 semaines, aucune différence significative n'a été constatée dans le score DAS28 entre le groupe d'intervention et le groupe de contrôle, bien que dans le groupe d'intervention le DAS28 se soit amélioré de manière significative par rapport au début de l'intervention (51).
En outre, une étude américaine récente a cherché à savoir si un régime à base de plantes sans restriction énergétique, mais avec l'élimination d'aliments spécifiques (par exemple, les aliments contenant du gluten, le sucre de table) suivie de leur réintroduction, affectait l'activité de la maladie chez les patients atteints de polyarthrite rhumatoïde, par rapport à un groupe placebo. Dans cette étude croisée de 16 semaines (le régime et la phase placebo ont duré 16 semaines avec une période d'élimination de 4 semaines), le score DAS28 et le nombre d'articulations enflées ont diminué de manière significative dans la phase de régime par rapport au groupe de contrôle (52).
Régimes sans gluten et polyarthrite rhumatoïde
Certaines études ont examiné les effets des variantes sans gluten du régime alimentaire à base de plantes (WFPD) dans la PR (53,54). On ne sait toujours pas dans quelle mesure la composante sans gluten du régime contribue à un effet positif sur l'inflammation ou sur d'autres symptômes (par exemple, la fatigue). Toutefois, dans la pratique, certains patients atteints de PR qui suivaient déjà un régime WFPB ont constaté des améliorations supplémentaires après être passés à un régime sans gluten. Il peut être intéressant d'expérimenter des aliments sans gluten en plus d'un régime WFPB ou d'un régime méditerranéen pendant une courte période, par exemple quelques mois, afin de déterminer si les symptômes s'améliorent davantage. Toutefois, comme il peut être plus difficile de consommer suffisamment de fibres dans le cadre d'un régime sans gluten, il est recommandé de ne supprimer les aliments contenant du gluten qu'en cas de bénéfice clinique.
L'impact du jeûne sur la polyarthrite rhumatoïde
Several studies show a short period of fasting followed by a vegetarian diet can cause clinically relevant long-term improvement in patients with RA (49, 54-57, 73). Although methods vary, they generally involve fasting periods of 7 – 10 days with a daily intake of 0-800 kcal. Although more scientific evidence is needed, fasts lasting 3 – 4 days may also be sufficient, and water fasting (<100 kcal per day) may be less effective than fasting based on vegetable soups and juices containing up to 800 kcal per day. The most well-known fasting method is the Buchinger method, in which, after a ‘tapering day,’ patients consume vegetable juices and broth (an average intake of 500 kcal per day). The Buchinger method is offered in clinics in Germany, where it is combined with other therapies such as relaxation exercises and gentle movement (e.g., yoga).
Malnutrition et perte musculaire
La malnutrition, due à des carences en nutriments, et la perte de masse musculaire sont des sujets de préoccupation pour les patients atteints de polyarthrite rhumatoïde. Pour les patients atteints de PR, un apport adéquat en nutriments peut être plus difficile en raison, par exemple, d'un manque d'appétit et de nausées comme effets secondaires des médicaments (en particulier avec l'utilisation courante du méthotrexate). En outre, l'utilisation de corticostéroïdes et l'inflammation chronique jouent un rôle dans la fonte musculaire et donc dans la réduction de la masse musculaire (74, 75).
La sarcopénie est une diminution de la masse, de la force et de la fonction musculaires, associée à une augmentation de la mortalité et de la morbidité, et sa prévalence est accrue chez les patients atteints de PR (jusqu'à 45 %) (58). Par conséquent, il convient de veiller tout particulièrement à ce que les apports protéiques et énergétiques soient suffisants chez les patients atteints de PR présentant un risque de malnutrition et/ou de sarcopénie.
Suppléments et polyarthrite rhumatoïde
En fonction du régime alimentaire, de la prise de médicaments et d'autres facteurs, une supplémentation peut être recommandée pour certains patients atteints de PR. Les aliments complets doivent être la première source de nutriments et doivent être préférés aux soi-disant suppléments nutritionnels. Cependant, dans certains cas, les compléments nutritionnels peuvent être conseillés ou apporter un bénéfice supplémentaire. Les compléments nutritionnels ne doivent être utilisés qu'après avoir consulté un médecin et/ou un diététicien qui connaissent les directives respectives concernant la prescription de compléments. Il est important de s'assurer qu'une personne reçoit des recommandations en fonction de ses besoins et de son état de santé de la part de professionnels de la santé qualifiés.
Veuillez noter que les recommandations suivantes sont uniquement d'ordre général. Veuillez vous référer aux directives locales pour obtenir des conseils spécifiques sur les recommandations individuelles en matière de compléments alimentaires.
Acide folique : Les patients atteints de maladies rhumatismales à qui l'on prescrit du méthotrexate (MTX est un médicament à prendre chaque semaine par voie orale ou sous-cutanée) doivent également recevoir une ordonnance d'acide folique, car le MTX est un antagoniste de l'acide folique. Il est généralement demandé aux patients de prendre au moins 5 g d'acide folique au moins 24 heures après la prise de MTX afin de réduire le risque d'hépatoxicité (59).
Vitamine D : En fonction de l'âge, de la pigmentation de la peau et de l'exposition quotidienne au soleil, de nombreux patients atteints de PR peuvent être invités à prendre 10 à 20 μg de vitamine D par jour. Une étude de cohorte a révélé que les femmes ayant l'apport total en vitamine D le plus élevé présentaient un risque de PR inférieur de 33 % à celui des femmes du groupe le plus faible (60). En outre, pour les personnes qui suivent un régime entièrement végétal, l'apport alimentaire en vitamine D peut être faible, il est donc recommandé de prendre un supplément de 25 à 50 μg (1 000 à 2 000 UI) par jour (61).
Vitamine B12 : en général, les personnes qui consomment principalement des aliments d'origine végétale, y compris celles qui souffrent de PR, doivent prendre un supplément de vitamine B12, car les aliments d'origine végétale n'en contiennent pas du tout ou en quantités négligeables. Certains produits d'origine végétale (par exemple, les produits laitiers) sont enrichis en vitamine B12, mais ce n'est généralement pas le cas des produits biologiques. En général, l'apport en vitamine B12 des aliments enrichis peut être trop faible et peut varier considérablement en fonction du produit et du pays. C'est pourquoi il est généralement recommandé de prendre un supplément pour garantir un apport adéquat.
Seule une partie de la vitamine B12 ingérée est absorbée, c'est pourquoi la dose de supplémentation est toujours supérieure à la dose journalière recommandée (par exemple, 250 - 500 mcg de cyanocobalamine ou 1 000 mcg de méthylcobalamine).
Le calcium : Les corticostéroïdes sont régulièrement utilisés chez les patients atteints de PR et augmentent le risque d'ostéoporose. En cas d'utilisation prolongée de doses élevées de corticostéroïdes (plus de 7,5 mg) pendant plus de trois mois, une supplémentation en calcium est souvent recommandée pour contrer le risque accru d'ostéoporose.
Acides gras oméga-3 : une méta-analyse de dix études a montré qu'une supplémentation d'au moins 2,7 g d'acides gras oméga-3 par jour pendant trois mois réduisait de manière significative l'utilisation des AINS chez les patients atteints de PR (62). Une tendance à la diminution de l'activité de la maladie a également été constatée, bien qu'elle ne soit pas significative.
Les poissons gras, les graines de lin, les graines de chia, les noix et les algues sont des exemples d'aliments riches en acides gras oméga-3. Les personnes qui souhaitent compléter les acides gras oméga-3 et qui suivent un régime alimentaire à base de plantes peuvent utiliser des suppléments d'huile d'algues. Bien que le poisson et l'huile de poisson soient riches en acides gras oméga-3, ils contiennent relativement plus de métaux lourds et de toxines que d'autres sources riches en oméga-3 comme les algues. En moyenne, le poisson ne représente que 1 à 2 % du régime alimentaire, mais il s'avère qu'il contribue à plus de 50 % de l'apport total en dioxines, en PCB de type dioxine et en métaux lourds chez les adultes (63). Lorsqu'elle est consommée quotidiennement à la dose recommandée, la supplémentation en huile de poisson peut contribuer à dépasser la dose journalière tolérable de certains métaux lourds et toxines (64).
La curcumine : La curcumine est le principal curcuminoïde (pigment polyphénolique) du curcuma et possède des propriétés anti-inflammatoires. La curcumine représente 77 % des curcuminoïdes présents dans le curcuma, alors que seuls 2,5 à 6 % du curcuma sont constitués de curcuminoïdes (76). À ce jour, l'efficacité de la supplémentation en curcumine a fait l'objet de nombreuses recherches. Une revue systématique de 2019 a trouvé des résultats peu concluants concernant les effets de la curcumine sur la PR, bien que de nombreuses études aient été rejetées parce qu'elles avaient été réalisées sans groupe de contrôle (65). Il est également important de noter que, dans ce domaine, plusieurs études ont été financées par des entreprises qui produisent leurs propres suppléments.
Dans le cas de la PR, une étude clinique contrôlée de huit semaines a montré qu'une supplémentation quotidienne de 1000 mg de curcuminoïdes était aussi efficace qu'une combinaison de 1000 mg de curcuminoïdes avec 100 mg de diclofénac ou seulement 100 mg de diclofénac (66). Les auteurs déclarent que les mécanismes moléculaires de la curcumine ne sont pas clairs, mais ils supposent que la curcumine pourrait réguler les cibles moléculaires qui contrôlent la douleur chronique (66). Par ailleurs, une étude animale a montré qu'une supplémentation en curcumine pouvait être bénéfique pour les rats atteints d'arthrite et traités au méthotrexate. Dans cette étude, l'ajout de curcumine s'est avéré bénéfique à la fois pour l'arthrite et pour la réduction de l'hépatotoxicité (67).
La supplémentation en curcumine semble sûre jusqu'à un maximum de 12 g par jour (68). Il est important de tenir compte de l'effet hypotenseur de la curcumine chez les personnes qui utilisent des médicaments hypotenseurs. Pour améliorer la biodisponibilité de la curcumine, il est recommandé de la combiner avec du poivre noir afin de renforcer ses effets bénéfiques sur la santé (69).
Conclusions et recommandations concernant des régimes alimentaires et des nutriments spécifiques dans la polyarthrite rhumatoïde
Malgré les résultats positifs concernant les régimes alimentaires composés principalement d'aliments végétaux, d'autres études sont nécessaires pour reproduire ces résultats (53). Néanmoins, on peut recommander aux patients atteints de PR d'adopter un régime à base d'aliments entiers d'origine végétale ou un régime méditerranéen, en plus des recommandations générales en matière d'alimentation saine et d'apport en nutriments dont il est question dans le présent article.
Heureusement, d'autres recherches sont actuellement menées dans ce domaine, notamment l'étude Plants for Joints à Amsterdam, aux Pays-Bas, où l'on étudie l'effet d'un programme de vie multidisciplinaire comprenant un régime à base de plantes, du mouvement et une gestion du stress et du sommeil pour les patients présentant un risque accru de PR (70). En outre, à Berlin, en Allemagne, un autre essai contrôlé randomisé étudie les effets du jeûne suivi d'un régime à base de plantes ou d'un régime anti-inflammatoire chez les patients atteints de PR (71). Nous nous attendons donc à de nouveaux résultats de recherche passionnants dans ce domaine au cours des prochaines années !
Informations complémentaires :
-
Carlijn Wagenaar, MD is the Chairperson for the branch of PAN in The Netherlands. She’s an MD and PhD researcher at Reade Rheumatology and Amsterdam University Medical Center. She investigates the influence of a plant-based lifestyle program on patients with rheumatoid arthritis and osteoarthritis, especially the microbiome and implementation in healthcare.
Wendy Walrabenstein, RD is the Treasurer for the branch of PAN in The Netherlands. She’s a dietician and PhD researcher at Reade Rheumatology in Amsterdam and Amsterdam University Medical Center. She investigates the effect of a plant-based lifestyle program on people with rheumatoid arthritis and osteoarthritis. Author of the book “Food Body Mind” which addresses the effects of lifestyle on inflammation and ageing, lecturer in Nutrition & Dietetics at the Amsterdam University of Applied Sciences, but also an economist with 15 years of experience in the international financial world.
-
Cross M, Smith E, Hoy D, Carmona L, Wolfe F, Vos T, et al. The global burden of rheumatoid arthritis: estimates from the Global Burden of Disease 2010 study. Ann Rheum Dis 2014;73(7):1316-1322.
Myasoedova E, Crowson CS, Kremers HM, Therneau TM, Gabriel SE. Is the incidence of rheumatoid arthritis rising?: results from Olmsted County, Minnesota, 1955-2007. Arthritis Rheum 2010 Jun;62(6):1576-1582.
Hunter TM, Boytsov NN, Zhang X, Schroeder K, Michaud K, Araujo AB. Prevalence of rheumatoid arthritis in the United States adult population in healthcare claims databases, 2004-2014. Rheumatol Int 2017 Sep;37(9):1551-1557.
Krishnan E, Lingala B, Bruce B, Fries JF. Disability in rheumatoid arthritis in the era of biological treatments. Ann Rheum Dis 2012 Feb;71(2):213-218.
Aga AB, Lie E, Uhlig T, Olsen IC, Wierød A, Kalstad S, et al. Time trends in disease activity, response and remission rates in rheumatoid arthritis during the past decade: results from the NOR-DMARD study 2000-2010. Ann Rheum Dis 2015 Feb;74(2):381-388.
England B, Mikuls T. Epidemiology of, risk factors for, and possible causes of rheumatoid arthritis. 2022; Available at: https://www.uptodate.com/contents/epidemiology-of-risk-factors-for-and-possible-causes-of-rheumatoid-arthritis.
Hsieh PH, Wu O, Geue C, McIntosh E, McInnes IB, Siebert S. Economic burden of rheumatoid arthritis: a systematic review of literature in biologic era. Ann Rheum Dis 2020 Jun;79(6):771-777.
Willett WC. Balancing life-style and genomics research for disease prevention. Science 2002 Apr 26;296(5568):695-698.
Viatte S, Plant D, Raychaudhuri S. Genetics and epigenetics of rheumatoid arthritis. Nat Rev Rheumatol 2013 Mar;9(3):141-153.
Furman D, Campisi J, Verdin E, Carrera-Bastos P, Targ S, Franceschi C, et al. Chronic inflammation in the etiology of disease across the life span. Nat Med 2019 Dec;25(12):1822-1832.
Hu Y, Sparks JA, Malspeis S, Costenbader KH, Hu FB, Karlson EW, et al. Long-term dietary quality and risk of developing rheumatoid arthritis in women. Ann Rheum Dis 2017 Aug;76(8):1357-1364.
Crowson CS, Matteson EL, Davis JM,3rd, Gabriel SE. Contribution of obesity to the rise in incidence of rheumatoid arthritis. Arthritis Care Res (Hoboken) 2013 Jan;65(1):71-77.
de Hair MJ, Landewé RB, van de Sande, M. G., van Schaardenburg D, van Baarsen LG, Gerlag DM, et al. Smoking and overweight determine the likelihood of developing rheumatoid arthritis. Ann Rheum Dis 2013 Oct;72(10):1654-1658.
Di Giuseppe D, Discacciati A, Orsini N, Wolk A. Cigarette smoking and risk of rheumatoid arthritis: a dose-response meta-analysis. Arthritis Res Ther 2014 Mar 5;16(2):R61.
Di Giuseppe D, Bottai M, Askling J, Wolk A. Physical activity and risk of rheumatoid arthritis in women: a population-based prospective study. Arthritis Res Ther 2015 Mar 4;17(1):40-2.
van Middendorp H, Evers AW. The role of psychological factors in inflammatory rheumatic diseases: From burden to tailored treatment. Best Pract Res Clin Rheumatol 2016 Oct;30(5):932-945.
Lee YC, Agnew-Blais J, Malspeis S, Keyes K, Costenbader K, Kubzansky LD, et al. Post-Traumatic Stress Disorder and Risk for Incident Rheumatoid Arthritis. Arthritis Care Res (Hoboken) 2016 Mar;68(3):292-298.
O’Donovan A, Cohen BE, Seal KH, Bertenthal D, Margaretten M, Nishimi K, et al. Elevated risk for autoimmune disorders in Iraq and Afghanistan veterans with posttraumatic stress disorder. Biol Psychiatry 2015 Feb 15;77(4):365-374.
Lee YC, Agnew-Blais J, Malspeis S, Keyes K, Costenbader K, Kubzansky LD, et al. Post-Traumatic Stress Disorder and Risk for Incident Rheumatoid Arthritis. Arthritis Care Res (Hoboken) 2016 Mar;68(3):292-298.
Zheng D, Liwinski T, Elinav E. Interaction between microbiota and immunity in health and disease. Cell Res 2020 Jun;30(6):492-506.
Blander JM, Longman RS, Iliev ID, Sonnenberg GF, Artis D. Regulation of inflammation by microbiota interactions with the host. Nat Immunol 2017 Jul 19;18(8):851-860.
Manasson J, Blank RB, Scher JU. The microbiome in rheumatology: Where are we and where should we go? Ann Rheum Dis 2020 Jun;79(6):727-733.
Valdes AM, Walter J, Segal E, Spector TD. Role of the gut microbiota in nutrition and health. BMJ 2018 Jun 13;361:k2179.
Rinninella E, Raoul P, Cintoni M, Franceschi F, Miggiano GAD, Gasbarrini A, et al. What is the Healthy Gut Microbiota Composition? A Changing Ecosystem across Age, Environment, Diet, and Diseases. Microorganisms 2019 Jan 10;7(1):14. doi: 10.3390/microorganisms7010014.
Illiano P, Brambilla R, Parolini C. The mutual interplay of gut microbiota, diet and human disease. FEBS J 2020 Mar;287(5):833-855.
Jethwa H, Abraham S. The evidence for microbiome manipulation in inflammatory arthritis. Rheumatology (Oxford) 2017 Sep 1;56(9):1452-1460.
Pianta A, Arvikar SL, Strle K, Drouin EE, Wang Q, Costello CE, et al. Two rheumatoid arthritis-specific autoantigens correlate microbial immunity with autoimmune responses in joints. J Clin Invest 2017 Aug 1;127(8):2946-2956.
Allam-Ndoul B, Castonguay-Paradis S, Veilleux A. Gut Microbiota and Intestinal Trans-Epithelial Permeability. Int J Mol Sci 2020 Sep 3;21(17):6402. doi: 10.3390/ijms21176402.
Scher JU, Sczesnak A, Longman RS, Segata N, Ubeda C, Bielski C, et al. Expansion of intestinal Prevotella copri correlates with enhanced susceptibility to arthritis. Elife 2013 Nov 5;2:e01202.
Ajeganova S, Huizinga T. Sustained remission in rheumatoid arthritis: latest evidence and clinical considerations. Ther Adv Musculoskelet Dis 2017 Oct;9(10):249-262.
Grove ML, Hassell AB, Hay EM, Shadforth MF. Adverse reactions to disease-modifying anti-rheumatic drugs in clinical practice. QJM 2001 Jun;94(6):309-319.
World healthy organization. Healthy diet. 2020; Available at: https://www.who.int/news-room/fact-sheets/detail/healthy-diet
Hansildaar R, Vedder D, Baniaamam M, Tausche AK, Gerritsen M, Nurmohamed MT. Cardiovascular risk in inflammatory arthritis: rheumatoid arthritis and gout. Lancet Rheumatol 2021 Jan;3(1):e58-e70.
Sigaux J, Semerano L, Favre G, Bessis N, Boissier MC. Salt, inflammatory joint disease, and autoimmunity. Joint Bone Spine 2018 Jul;85(4):411-416.
Calder PC. N-3 Polyunsaturated Fatty Acids, Inflammation, and Inflammatory Diseases. Am J Clin Nutr 2006 Jun;83(6 Suppl):1505S-1519S.
Calder PC. Omega-3 fatty acids and inflammatory processes: from molecules to man. Biochem Soc Trans 2017 Oct 15;45(5):1105-1115.
World Health Organisation. Physical activity. 2020; Available at: https://www.who.int/news-room/fact-sheets/detail/physical-activity
Anderson JW, Baird P, Davis RH,Jr, Ferreri S, Knudtson M, Koraym A, et al. Health benefits of dietary fiber. Nutr Rev 2009 Apr;67(4):188-205.
Häger J, Bang H, Hagen M, Frech M, Träger P, Sokolova MV, et al. The Role of Dietary Fiber in Rheumatoid Arthritis Patients: A Feasibility Study. Nutrients 2019 Oct 7;11(10):2392. doi: 10.3390/nu11102392.
Slavin J. Fiber and prebiotics: mechanisms and health benefits. Nutrients 2013 Apr 22;5(4):1417-1435.
Mukherjee A, Lordan C, Ross RP, Cotter PD. Gut microbes from the phylogenetically diverse genus Eubacterium and their various contributions to gut health. Gut Microbes 2020 Nov 9;12(1):1802866.
Singh RK, Chang HW, Yan D, Lee KM, Ucmak D, Wong K, et al. Influence of diet on the gut microbiome and implications for human health. J Transl Med 2017 Apr 8;15(1):73-y.
Holscher HD. Dietary fiber and prebiotics and the gastrointestinal microbiota. Gut Microbes 2017 Mar 4;8(2):172-184.
Tomova A, Bukovsky I, Rembert E, Yonas W, Alwarith J, Barnard ND, et al. The Effects of Vegetarian and Vegan Diets on Gut Microbiota. Front Nutr 2019 Apr 17;6:47.
De Filippo C, Cavalieri D, Di Paola M, Ramazzotti M, Poullet JB, Massart S, et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa. Proc Natl Acad Sci U S A 2010 Aug 17;107(33):14691-14696.
De Filippis F, Pellegrini N, Vannini L, Jeffery IB, La Storia A, Laghi L, et al. High-level adherence to a Mediterranean diet beneficially impacts the gut microbiota and associated metabolome. Gut 2016 Nov;65(11):1812-1821.
Wagenaar CA, van de Put M, Bisschops M, Walrabenstein W, de Jonge CS, Herrema H, et al. The Effect of Dietary Interventions on Chronic Inflammatory Diseases in Relation to the Microbiome: A Systematic Review. Nutrients 2021 Sep 15;13(9):3208. doi: 10.3390/nu13093208.
Wastyk HC, Fragiadakis GK, Perelman D, Dahan D, Merrill BD, Yu FB, et al. Gut-microbiota-targeted diets modulate human immune status. Cell 2021 Aug 5;184(16):4137-4153.e14.
Kjeldsen-Kragh J, Haugen M, Borchgrevink CF, Laerum E, Eek M, Mowinkel P, et al. Controlled trial of fasting and one-year vegetarian diet in rheumatoid arthritis. Lancet 1991 Oct 12;338(8772):899-902.
Sköldstam L, Hagfors L, Johansson G. An experimental study of a Mediterranean diet intervention for patients with rheumatoid arthritis. Ann Rheum Dis 2003 Mar;62(3):208-214.
Vadell AKE, Bärebring L, Hulander E, Gjertsson I, Lindqvist HM, Winkvist A. Anti-inflammatory Diet In Rheumatoid Arthritis (ADIRA)-a randomized, controlled crossover trial indicating effects on disease activity. Am J Clin Nutr 2020 Jun 1;111(6):1203-1213.
Barnard ND, Levin S, Crosby L, Flores R, Holubkov R, Kahleova H. A Randomized, Crossover Trial of a Nutritional Intervention for Rheumatoid Arthritis. American Journal of Lifestyle Medicine 2022:15598276221081819.
Hagen KB, Byfuglien MG, Falzon L, Olsen SU, Smedslund G. Dietary interventions for rheumatoid arthritis. Cochrane Database Syst Rev 2009 Jan 21;(1):CD006400. doi(1):CD006400.
Hafström I, Ringertz B, Gyllenhammar H, Palmblad J, Harms-Ringdahl M. Effects of fasting on disease activity, neutrophil function, fatty acid composition, and leukotriene biosynthesis in patients with rheumatoid arthritis. Arthritis Rheum 1988 May;31(5):585-592.
Sköldstam L, Larsson L, Lindström FD. Effect of fasting and lactovegetarian diet on rheumatoid arthritis. Scand J Rheumatol 1979;8(4):249-255.
Abendroth A, Michalsen A, Lüdtke R, Rüffer A, Musial F, Dobos GJ, et al. Changes of Intestinal Microflora in Patients with Rheumatoid Arthritis during Fasting or a Mediterranean Diet. Forsch Komplementmed 2010;17(6):307-313.
Udén AM, Trang L, Venizelos N, Palmblad J. Neutrophil functions and clinical performance after total fasting in patients with rheumatoid arthritis. Ann Rheum Dis 1983 Feb;42(1):45-51.
An HJ, Tizaoui K, Terrazzino S, Cargnin S, Lee KH, Nam SW, et al. Sarcopenia in Autoimmune and Rheumatic Diseases: A Comprehensive Review. Int J Mol Sci 2020 Aug 7;21(16):5678. doi: 10.3390/ijms21165678.
Liu L, Liu S, Wang C, Guan W, Zhang Y, Hu W, et al. Folate Supplementation for Methotrexate Therapy in Patients With Rheumatoid Arthritis: A Systematic Review. J Clin Rheumatol 2019 Aug;25(5):197-202.
Merlino LA, Curtis J, Mikuls TR, Cerhan JR, Criswell LA, Saag KG, et al. Vitamin D intake is inversely associated with rheumatoid arthritis: results from the Iowa Women’s Health Study. Arthritis Rheum 2004 Jan;50(1):72-77.
Melina V, Craig W, Levin S. Position of the Academy of Nutrition and Dietetics: Vegetarian Diets. J Acad Nutr Diet 2016 Dec;116(12):1970-1980.
Lee YH, Bae SC, Song GG. Omega-3 polyunsaturated fatty acids and the treatment of rheumatoid arthritis: a meta-analysis. Arch Med Res 2012 Jul;43(5):356-362.
Bilau M, Matthys C, Baeyens W, Bruckers L, De Backer G, Den Hond E, et al. Dietary exposure to dioxin-like compounds in three age groups: results from the Flemish environment and health study. Chemosphere 2008 Jan;70(4):584-592.
Bourdon JA, Bazinet TM, Arnason TT, Kimpe LE, Blais JM, White PA. Polychlorinated biphenyls (PCBs) contamination and aryl hydrocarbon receptor (AhR) agonist activity of Omega-3 polyunsaturated fatty acid supplements: implications for daily intake of dioxins and PCBs. Food Chem Toxicol 2010 Nov;48(11):3093-3097.
Yang M, Akbar U, Mohan C. Curcumin in Autoimmune and Rheumatic Diseases. Nutrients 2019 May 2;11(5):1004. doi: 10.3390/nu11051004.
Chandran B, Goel A. A randomized, pilot study to assess the efficacy and safety of curcumin in patients with active rheumatoid arthritis. Phytother Res 2012 Nov;26(11):1719-1725.
Banji D, Pinnapureddy J, Banji OJ, Saidulu A, Hayath MS. Synergistic activity of curcumin with methotrexate in ameliorating Freund’s Complete Adjuvant induced arthritis with reduced hepatotoxicity in experimental animals. Eur J Pharmacol 2011 Oct 1;668(1-2):293-298.
Anand P, Kunnumakkara AB, Newman RA, Aggarwal BB. Bioavailability of curcumin: problems and promises. Mol Pharm 2007;4(6):807-818.
Mimica B, Bučević Popović V, Banjari I, Jeličić Kadić A, Puljak L. Methods Used for Enhancing the Bioavailability of Oral Curcumin in Randomized Controlled Trials: A Meta-Research Study. Pharmaceuticals (Basel) 2022 Jul 28;15(8):939. doi: 10.3390/ph15080939.
Walrabenstein W, van der Leeden M, Weijs P, van Middendorp H, Wagenaar C, van Dongen JM, et al. The effect of a multidisciplinary lifestyle program for patients with rheumatoid arthritis, an increased risk for rheumatoid arthritis or with metabolic syndrome-associated osteoarthritis: the “Plants for Joints” randomized controlled trial protocol. Trials 2021;22(1):715.
Hartmann AM, Dell’Oro M, Kessler CS, Schumann D, Steckhan N, Jeitler M, et al. Efficacy of therapeutic fasting and plant-based diet in patients with rheumatoid arthritis (NutriFast): study protocol for a randomised controlled clinical trial. BMJ Open 2021 Aug 11;11(8):e047758-047758.
Gwinnutt JM, Wieczorek M, Balanescu A, et al2021 EULAR recommendations regarding lifestyle behaviours and work participation to prevent progression of rheumatic and musculoskeletal diseases. Annals of the Rheumatic Diseases. Published Online First: 08 March 2022. doi: 10.1136/annrheumdis-2021-222020
Müller H, de Toledo FW, Resch KL. Fasting followed by vegetarian diet in patients with rheumatoid arthritis: a systematic review. Scand J Rheumatol. 2001;30(1):1-10. doi: 10.1080/030097401750065256. PMID: 11252685.
Hasselgren PO, Alamdari N, Aversa Z, Gonnella P, Smith IJ, Tizio S. Corticosteroids and muscle wasting: role of transcription factors, nuclear cofactors, and hyperacetylation. Curr Opin Clin Nutr Metab Care. 2010 Jul;13(4):423-8. doi: 10.1097/MCO.0b013e32833a5107. PMID: 20473154; PMCID: PMC2911625.
Dalle S, Rossmeislova L, Koppo K. The Role of Inflammation in Age-Related Sarcopenia. Front Physiol. 2017 Dec 12;8:1045. doi: 10.3389/fphys.2017.01045. PMID: 29311975; PMCID: PMC5733049.
Lee WH, Loo CY, Bebawy M, Luk F, Mason RS, Rohanizadeh R. Curcumin and its derivatives: their application in neuropharmacology and neuroscience in the 21st century. Curr Neuropharmacol. 2013 Jul;11(4):338-78. doi: 10.2174/1570159X11311040002. PMID: 24381528; PMCID: PMC3744901.